注冊證號 國藥準(zhǔn)字HJ20171075
原注冊證號 H20171075
上市許可持有人英文名稱 Janssen-Cilag International N.V.
上市許可持有人地址(英文) Turnhoutseweg 30, B-2340 Beerse, Belgium
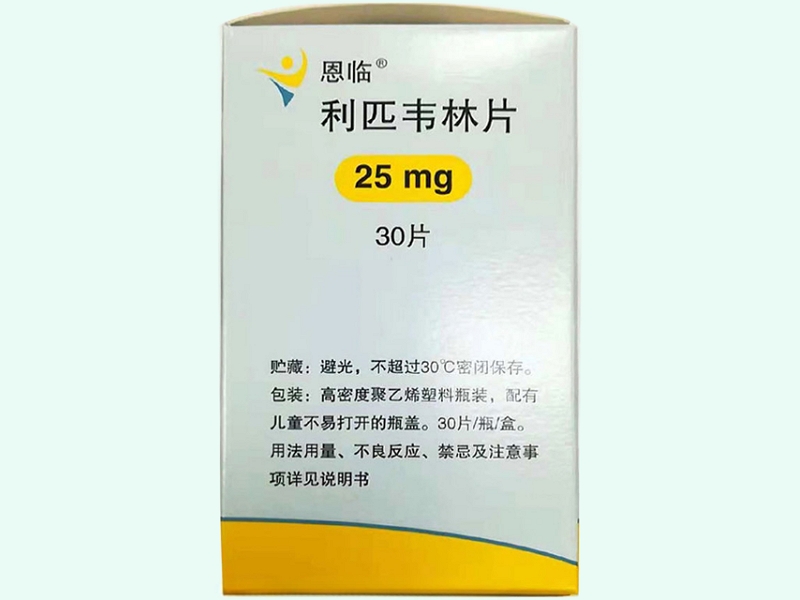
產(chǎn)品名稱(中文) 利匹韋林片
產(chǎn)品名稱(英文) Rilpivirine Tablets
商品名(中文) 恩臨
商品名(英文) EDURANT
劑型(中文) 片劑
規(guī)格(中文) 25mg
包裝規(guī)格(中文) 30片/瓶/盒
生產(chǎn)廠商(英文) Janssen-Cilag SpA
廠商地址(英文) Via C. Janssen, Borgo San Michele, 04100 Latina, Italy
廠商國家/地區(qū)(中文) 意大利
廠商國家/地區(qū)(英文) Italy
發(fā)證日期 2022-04-29
有效期截止日 2027-04-28
境內(nèi)責(zé)任人名稱 西安楊森制藥有限公司
境內(nèi)責(zé)任人統(tǒng)一社會信用代碼 91610000623100825C
境內(nèi)責(zé)任人通訊地址 北京市朝陽區(qū)建國路77號 華貿(mào)中心寫字樓三號樓14層
藥品本位碼 86978537000438
產(chǎn)品類別 化學(xué)藥品

