注冊證號 國藥準字HJ20150220
原注冊證號 H20150220
上市許可持有人英文名稱 Pfizer Europe MA EEIG
上市許可持有人地址(英文) Boulevard de la Plaine 17, 1050 Bruxelles, Belgium
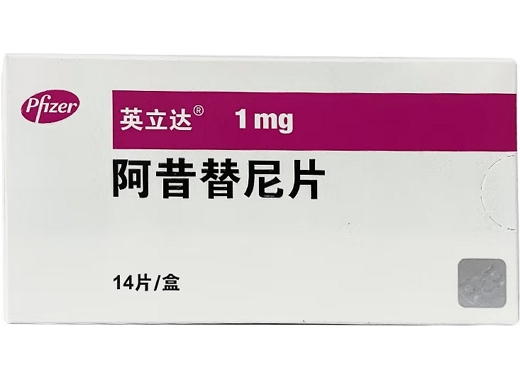
產(chǎn)品名稱(中文) 阿昔替尼片
產(chǎn)品名稱(英文) Axitinib Tablets
商品名(中文) 英立達
商品名(英文) Inlyta
劑型(中文) 片劑
規(guī)格(中文) 1mg
包裝規(guī)格(中文) 14片/盒,56片/盒
生產(chǎn)廠商(英文) Pfizer Manufacturing Deutschland GmbH
廠商地址(英文) Betriebsstatte Freiburg, Mooswaldallee 1, 79090 Freiburg, Germany
廠商國家/地區(qū)(中文) 德國
廠商國家/地區(qū)(英文) Germany
發(fā)證日期 2024-08-19
有效期截止日 2029-08-18
藥品本位碼 86978724001057
產(chǎn)品類別 化學藥品

